la tabla periodica
viernes, 7 de noviembre de 2014
Grupos[editar]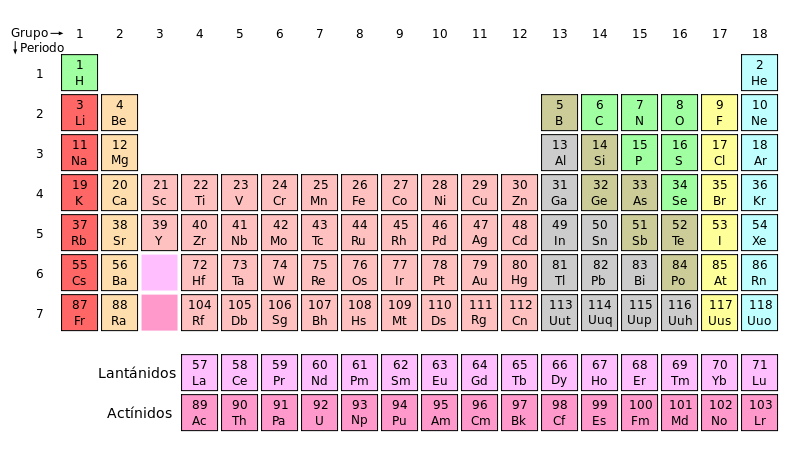
A las columnas verticales de la tabla periódica se les conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos: la tabla periódica se ideó para ordenar estas familias de una forma coherente y fácil de ver.
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, entendido como el número de electrones en la última capa, y por ello, tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicas similares y la mismavalencia atómica, o número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares.
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica ns1 y una valencia de 1 (un electrón externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son también llamados gases inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre paréntesis según el sistema estadounidense,8 los grupos de la tabla periódica son:
|
Períodos[editar]
| 1s | |||||
| 2s | 2p | ||||
| 3s | 3p | ||||
| 4s | 3d | 4p | |||
| 5s | 4d | 5p | |||
| 6s | 4f | 5d | 6p | ||
| 7s | 5f | 6d | 7p |
Las filas horizontales de la tabla periódica son llamadas períodos. El número de niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden:
Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica. Los electrones situados enniveles más externos determinan en gran medida las propiedades químicas, por lo que éstas tienden a ser similares dentro de un mismo grupo, sin embargo la masa atómica varía considerablemente incluso entre elementos adyacentes. Al contrario, dos elementos adyacentes de mismo periodo tienen una masa similar, pero propiedades químicas diferentes.
La tabla periódica consta de 7 períodos:
ejercicios
| 1) Completar el siguiente cuadro: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2) El Br, como vemos en la tabla periódica tiene una masa cercana a 80, pero el 80Br no se encuentra en la naturaleza. ¿Cómo podemos explicar este concepto?.
3) Tenemos átomos de Na y los ordenamos en una hilera a lo largo de una cuadra (120m). Si suponemos que son esferas y no ejercen ningún tipo de fuerza entre ellas, ¿Cuántos átomos necesitamos para cubrir esa distancia? Radio Na= 186 pm
4) El oxígeno tiene 3 isótopos 168O (99,759%) con masa atómica 15,99491 umas, 178O (0,037%) con un masa atómica de 16,99914 umas y 188O (0,204%) con una masa de 17,99916. ¿Cuál es la masa atómica del oxígeno?
5) La masa atómica del Cloro es 35,45. La masa del isótopo 3517Cl es 34,96885 y la del isótopo 3717Cl es de 36,9659. Con estos datos averigue ¿cuál es la abundancia de cada isótopo en la naturaleza?
6) Se cree que el protón tiene un radio de 1,3 10-13 cm y una masa de 1,67 x 10–24 g.
7) Indique cuál de estas especies son isoelectrónicas entre sí: S-2 , O-2 , F- , K+ , Br - , Li+ , Ar , Cl- , Ne, Al+3 , Na+ , Ca+2
8) Completar la siguiente tabla, donde la columna de masas atómicas está referida a los que aparecen en la tabla periódica:
a) ¿Cuál es la masa de un átomo de Al en g y umas?
10) Dos moles de átomos de Ni tienen la misma masa que 1.223 moles de átomos de otro elemento. ¿Cuál es la masa atómica de este otro elemento?. ¿Cuál será?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
composición de la tabla periodica
Metales, no metales, gases nobles
Una primera clasificación de la tabla es entre Metales, No Metales y Gases Nobles o Inertes.La mayor parte de los elementos de la tabla periódica son metales.
METALES
Son buenos conductores de calor y de la electricidad, con un brillo caracteristico y solidos a temperatura ordinaria, salvo el Mercurio. Sus atomos tienen tendencia a ceder los electrones de su capa mas externa, convirtiendose en iones positivos. Tienen altos puntos de fusión y de ebullición. Poseen elevadas densidades; es decir tienen muchos atomos juntos en un pequeño volumen. Algunos tienen propiedades magneticas. Son ductiles y maleables, presentan brillo. Hay algunas excepciones a las propiedades generales enunciadas anteriormente:
El mercurio es un metal pero es líquido a temperatura ambiente.
El sodio es metal pero es blando (se raya con facilidad) y flota (baja densidad). Se clasifican en:
Metales reactivos:Se denomina así a los elementos de las dos primeras columnas (alcalinos y alcalinotérreos) al ser los metales más reactivos por regla general.
Metales de transición:Son los cuarenta elementos químicos, del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112. El nombre de "transición" proviene de una caracteristica que presentan estos elementos de poder ser estables por si mismos sin necesidad de una reaccion con otro elemento.
Otros metales:Son los que se encuentran en el resto de grupos largos. Algunos de ellos tienen propiedades de no metal en determinadas circunstancias (semimetales o metaloides).
METALES REACTIVOS
GRUPO IA
Metales alcalinos:Son blandos, conducen bien la electricidad y el calor, presentan densidades muy bajas, reaccionan rapidamente ante el agua o el oxigeno. En la naturaleza no se encuentran como elementos libres sino como compuestos.Son altamente reactivos.
GRUPO IIA
Metales alcalinoterreos:Su densidad es baja, en la naturaleza se encuentran formando compuestos. Su color es blanco plateado, su aspecto es lustroso y son blandos. Son menos reactivos que los metales alcalinos. A pesar de ser fragiles son ductiles y maleables. Son menos quimicamente reactivos que los metales alcalinos.
METALES DE TRANSICION
GRUPO IIIA a IIB
Metales de transicion externa:No se cosideran metales de transicion externa a el escandio, zinc, itrio, cadmio y mercurio. La IUPAC define un metal de transición como "un elemento cuyo átomo tiene una subcapa d incompleta. Estos metales son quebradizos y tienen puntos de fusion y ebullicion mas altos que los otros metales. Cuando a su ultima capa de valencia le faltan electrones para estar completa, los extrae de capas internas. Con eso es estable, pero le faltarían electrones en la capa donde los extrajo, asi que los acompleta con otros electrones propios de otra capa. Y asi sucesivamente; este fenomeno se le llama "Transición electronica". Esto tambien tiene que ver con que estos elementos sean tan estables y dificiles de reaccionar con otros. Sus combinaciones son fuertemente coloreadas. Pueden formar aleaciones entre ellos.
ELEMENTOS DE TRANSICION INTERNA
Lantanidos:Son elementos trivalentes (tienen 3 numeros de oxidacion), a excepcion del Cerio. Forman parte de este grupo los elementos con numero atomico desde el 58 hasta el 71(incluyendo al escandio y el itrio), aunque a veces se incluye al Lantano (57) ya que tiene propiedades similares a los lantánidos, pero no completa el subnivel 4f; lo que distingue atomicamente a estos elementos. Tambien son denominados como tierras raras porque fueron originalmente descubiertas juntas en minerales raros e insolados como óxidos, o "tierras". Reaccionan lentamente con el aire, excepto el Samario, el Europio, y el Iterbio, que son mucho mas reactivos con el oxígeno. Este es pirofosfórico (atrapan fuego en aire) cuando finalmente se dividió y es usado para hacer encendedores, tambien se utilizan fosforos y en pantallas de televisor.
Actinidos:Estos elementos se encuentran encabezados por el elemento actinio (89) hasta el laurencio (103). Como grupo son significativamente importantes debido a la radioactividad. Sólo los cuatro primeros se han encontrado en la naturaleza en cantidades apreciables; los demás han sido producidos artificialmente. Los elementos con números atómicos 93 y siguientes se llaman elementos transuránicos.Resultan esenciales en el proceso de obtención de energía atómica.
OTROS METALES
Metaloides o semimetales:Son los elementos que se encuentran en la region intermedia entre los metales y los no metales. Sus propiedades son tambien, por lo general, de caracter intermedio. Por ejemplo, los metales son buenos conductores de la electricidad, los no son conductores y los metaloides son semiconductores electricos (la conducen solo en un sentido). Otra carcteristica es que cuando reaccionan con metales, se comportan como NO metales, y cuando reaccionan con NO metales, se comportan como metales. Pueden ser tanto brillantes como opacos.
NO METALES
En general se pueden presentar en todos los estados fisicos a temperatura y presion normales. Se caracterizan por presentar una alta electronegatividad, por lo que es mas facil que ganen electrones a que lo pierdan. Son malos conductores de calor y la electricidad. Son poco resistentes y se desgastan con facilidad. No reflejan la luz como los metales, no tienen el denominado brillo metálico. No son atraídos por los imanes. Hay algunas excepciones a las propiedades generales enunciadas anteriormente:
El diamante es un no metal pero presenta una gran dureza.
El grafito es un no metal pero conduce la electricidad. Se clasifican en:
Carbonoideos:Elementos del grupo 14, también se conocido como grupo del carbono (Está compuesto por:Carbono, Silicio, Germanio, Estaño,Plomo).
Nitrogenoideos:Elementos del grupo 15, también se conocido como grupo del Nitrogeno (Está compuesto por:Nitrógeno, Fósforo, Arsénico, Antimonio y Bismuto).
Calcógenos:Elementos del grupo 16 (Está compuesto por: Oxígeno, Azufre, Selenio, Telurio y Polonio).
Halógenos:Elementos del grupo 17 (Está compuesto por Fluor, Cloro, Bromo, Yodo, Astato).
GASES NOBLES O INERTES
Los gases nobles son elementos químicos situados en el grupo 18 de la tabla periódica de los elementos. Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan «inertes». El nitrógeno y el platino son ejemplos de elementos inertes. (Durante muchos años los quimicos creyeron que eran inertes porque sus capas exteriores estaban totalmente ocupadas por electrones); se sabe que esto no es cierto ya que se logro, aunque con cierta dificultad, formar compuestos con estos elementos. Tambien son llamados "Gases Nobles" porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia.
LA TABLA PERIODICA SE ORDENA EN :
PERIODOS
Las filas horizontales de la Tabla Periódica son llamadas Períodos. La tabla periodica consta de 7 periodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca de acuerdo a su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno y helio, ambos tienen solo el orbital 1s. El primer elemento de cada periodo tiene un electron mas de valencia en su nivel energetico mas alto.
GRUPOS
A las columnas verticales de la Tabla Periódica se las conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia, y por ello, tienen características o propiedades similares entre si. Por ejemplo los elementos en el grupo IA tienen valencia de 1 (un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los Gases Nobles, los cuales tienen su último nivel de energía lleno (regla del octeto) y por ello son todos extremadamente no-reactivos.
ELECTRONEGATIVIDAD
La electronegatividad de un elemento es la capacidad que tiene un átomo de dicho elemento para atraer hacia sí los electrones, cuando forma parte de un compuesto. Si un átomo tiene una gran tendencia a atraer electrones se dice que es muy electronegativo (como los elementos próximos al flúor) y si su tendencia es a perder esos electrones se dice que es muy electropositivo (como los elementos alcalinos). La electronegatividad tiene numerosas aplicaciones tanto en las energías de enlaces, como en las predicciones de la polaridad de los enlaces y las moléculas y, también, en la racionalización de los tipos de reacciones que pueden experimentar las especies químicas. Incrementa de abajo hacia arriba, y de izquierda a derecha según en el orden de la tabla periódica, con excepción del Indio, que es mayor que el Galio (el cuál carece de mucha electricidad, por sus pocos electrones) a pesar de estar debajo de el en la tabla periódica.
Suscribirse a:
Entradas (Atom)

.jpg)